本研究では,以下の点について研究を行いました.
以下,それぞれについて説明します.
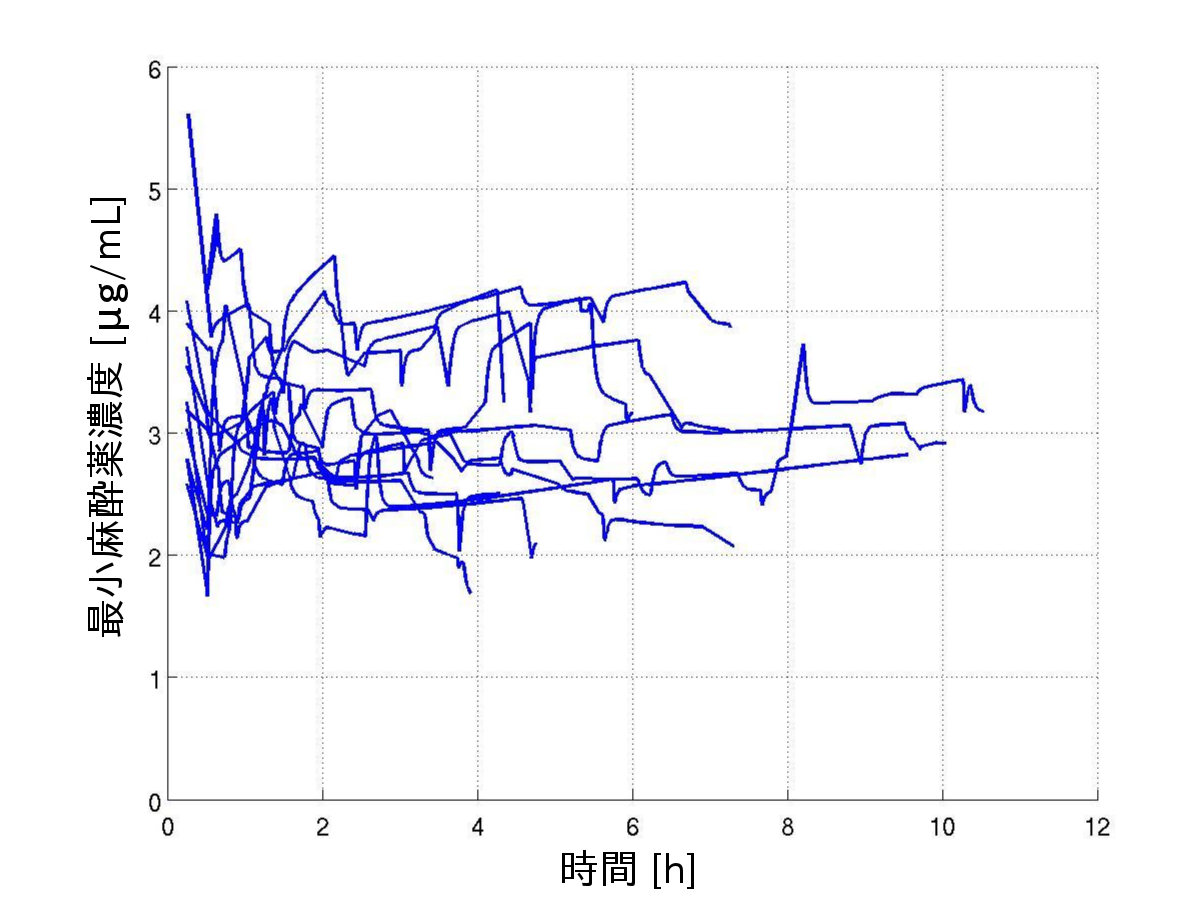
全身麻酔に用いられる麻酔薬propofolの効果は麻酔継続時間とともに 変化していくと考えられます. 麻酔薬を一定速度で投与する場合,この変化のために手術中に鎮静状態が不十分となり 覚醒してしまう危険性があると考えられます. そこでまず,麻酔時間が4時間以上の手術における臨床データから 麻酔継続時間と十分な鎮静状態が維持される効果部位(麻酔薬が効果を 表す体の部位)の麻酔薬濃度の関係を求めました.
その結果,麻酔時間と従来の薬物動態モデル(体内での麻酔薬の移動や 代謝などを表すモデル)を 利用して求めた鎮静状態を維持できる最小の効果部位麻酔薬濃度は 下図のように変化することがわかりました[3], [5].

ただし,薬物動態モデルとしては,Sawaguchiのモデル[11]を利用しました.
また,この変化に対応する数式モデルを求めました. その結果,薬物動態モデルの血中における代謝速度のパラメータを 1時間あたり5%程度増加させたモデルを利用することで, 一定の(モデルによる推定)麻酔薬濃度に維持すれば 鎮静状態が維持されることがわかりました[3].
体内の麻酔薬濃度はリアルタイムで測定できませんので, 年齢,性別,体重,身長などをパラメータとして含む モデルを利用して推定されています. 体内の麻酔薬propofol濃度の変化を表すモデルとして, 現在までに多くのモデルが提案されていますが, 本研究で利用する鎮痛度指標aepEXに基づく 鎮静度の自動制御に適したモデルを, 鎮静状態と覚醒状態の判別精度を比較することにより決めることとしました.
検討の結果, 鎮静状態と覚醒状態の判別精度が最も高いモデルはBarrの モデル[12]であること, 麻酔薬濃度の推定によく利用されているMarshモデル[13]や Schniderモデル[14]も精度が高いことがわかりました.
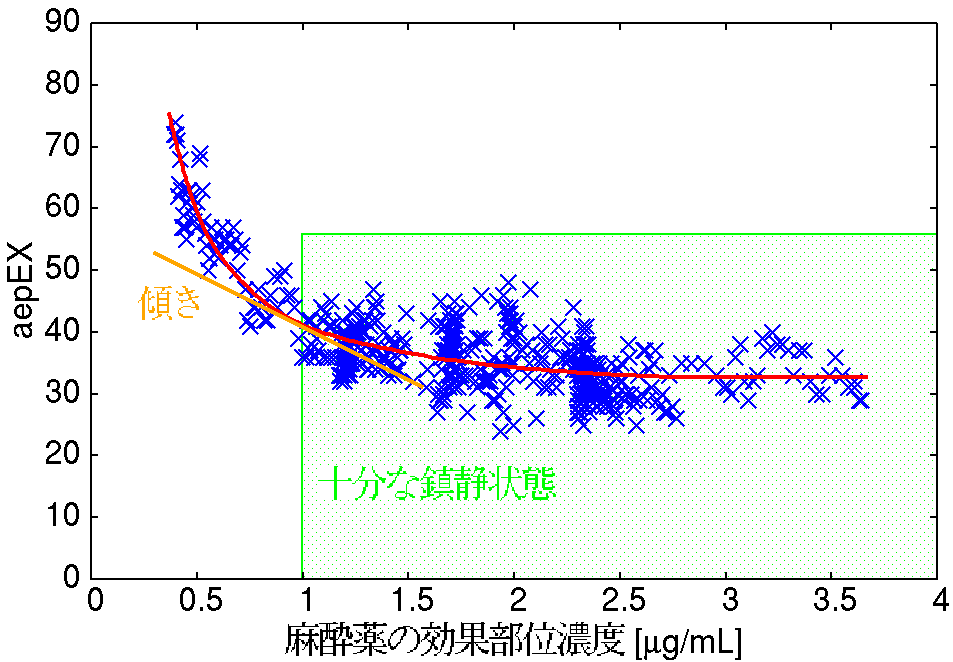
また,判別精度のよいモデルを用いて推定した麻酔薬濃度と aepEXの関係から, 鎮静状態を維持できる最小の効果部位麻酔薬濃度を推定する方法を検討しました. Barrのモデルで推定した麻酔薬濃度とaepEXの関係は 下図のようになり,麻酔薬濃度の減少に対して aepEXが上昇する傾きを求めることで, 鎮静状態を維持できる麻酔薬濃度が適切に推定できることがわかりました. また,このことを利用して 鎮静状態を維持できる最小効果部位麻酔薬濃度の推定法を提案しました[1], [2], [8].
1.で求めたモデルに基づいて,2.で提案した推定法を用いて 求めた最小麻酔薬濃度以上に麻酔薬濃度を常に調整することで, 患者を適切な鎮静状態に維持する鎮静度制御法を提案しました[3]. また,シミュレーションにより,従来よりも手術中の麻酔薬の 急速投与の可能性が低くなり,麻酔継続時間が長時間となっても, 望ましい鎮静度制御が実現できることを確認しました[3], [6].
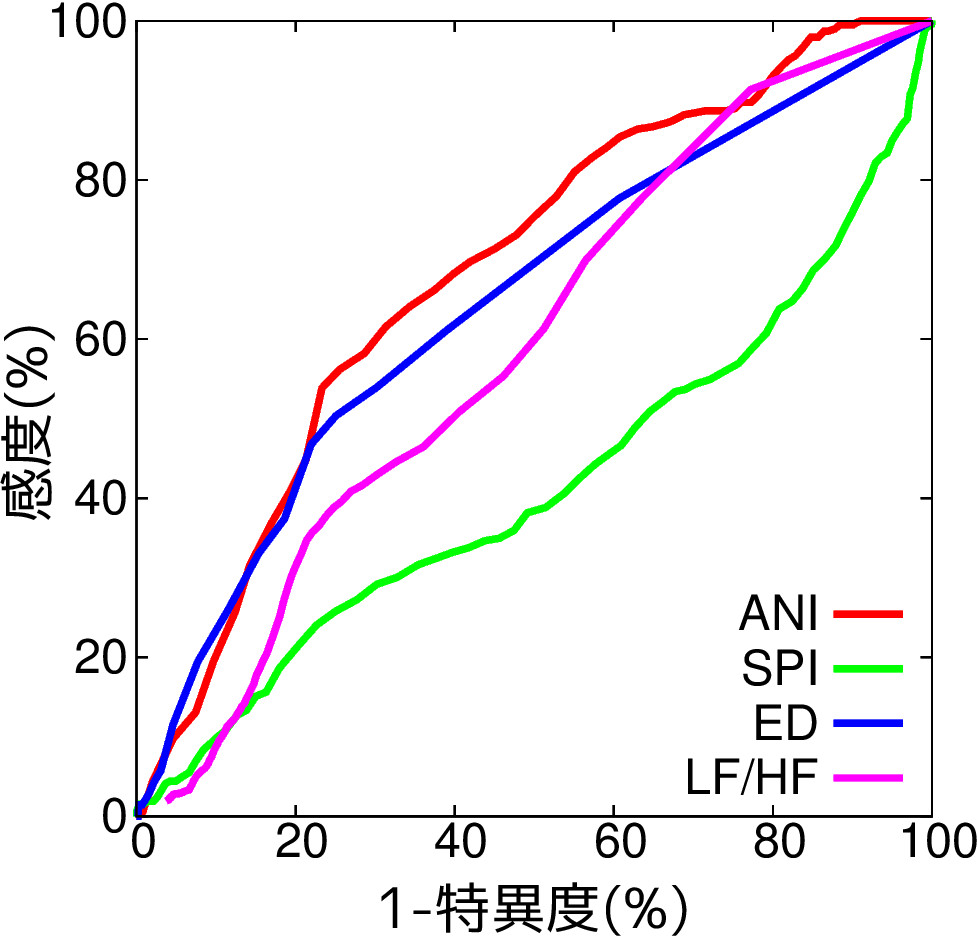
手術においては,鎮静状態だけでなく鎮痛状態を適切に維持することも必要ですが, 麻酔中の鎮痛状態を確実に把握できる指標は現在のところありません. 現在までに,心拍間隔変動の周波数スペクトルに基づくLF/HF [15], 心拍間隔変動から求められる鎮痛侵害受容指数(Analgesia/Nociception Index; ANI) [16], 脈波に基づくSurgical Pleth Index (SPI) [17], 顔面筋電信号に基づくEntropy Difference (ED) [18]などが 有望な指標として提案されていますが, これらのそれぞれについて,鎮痛が不十分だと考えられる体動のある時間帯や 挿管,抜管,皮切などの手術中の痛み刺激による鎮痛状態の変化を 適切に把握できるかを,指標から鎮痛状態であることを正しく把握できる 割合である感度と鎮痛状態でないことを正しく把握できる割合である 特異度を調べることにより検討しました.
その結果,横軸を(1-(特異度)),縦軸を感度として描いたグラフ (受信者動作特性曲線(ROC曲線)といいます)を下図に示します. ROC曲線は左上に近いほど望ましいのですが, この結果からANIが最も鎮痛状態を把握するのに適していることが わかりました[10]. ただし,今回の結果は手術中のさまざまな痛み刺激を考慮に入れていないので, さらなる検討が必要であると考えられます.
現在よく利用されている麻酔薬propofolと鎮痛薬remifentanilには 効果を強めあう相互作用があります. したがって,同時に利用する際には相互作用を考慮に入れて 投与量を調整する必要があります. 本研究では,実際のデータに基づいて相互作用の特性を確認し, 適切な鎮静・鎮痛状態を維持できる制御法を検討しました.
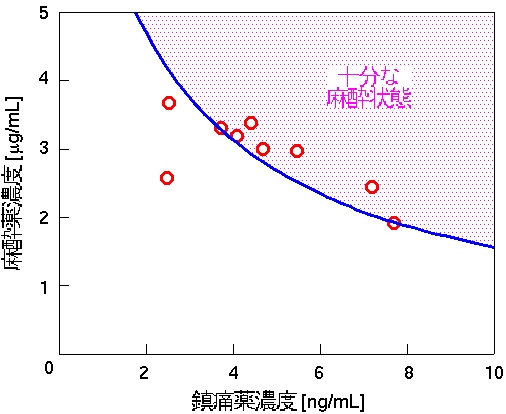
まず,手術時のデータから,鎮静および鎮痛状態がいずれも 適切に維持されている時間帯の麻酔薬および鎮痛薬濃度を求め, 適切な麻酔状態に対応する濃度の範囲を求めました. その結果を下図に示します. 図の青線の右上の範囲が適切な麻酔状態に対応する範囲となり, 従来われわれが提案してきた モデルで 相互作用が表せることが確認できました. また,鎮静度と鎮痛度を同時に制御する場合は, 鎮痛度指標が十分な信頼性を持っていないことを考慮に入れて, まず鎮痛薬濃度が十分になるように投与したうえで, 3.で述べた鎮静度制御の方法を利用して適切な麻酔状態を維持できる範囲に 麻酔薬濃度を調整することで, 鎮静・鎮痛状態ともに適切に維持できることがわかりました[9]. ただし,最初に鎮痛状態が十分になるように鎮痛薬を投与する方法は 今後検討する必要があります.
[1] 古谷栄光,西垣勇輝,武田敏宏,白神豪太郎, 鎮静度指標aepEXを用いた鎮静度自動制御法, 第18回日本静脈麻酔学会 (2011)
[2] 神田千秋,古谷栄光,白神豪太郎,武田敏宏, 聴覚誘発電位に基づく鎮静度指標aepEXを用いた鎮静度制御システムの改良, 第56回システム制御情報学会研究発表講演会 477/478 (2012)
[3] 中山裕,古谷栄光,白神豪太郎,武田敏宏, 麻酔薬投与時間による生体の特性変化を考慮した鎮静度制御システム, 第55回自動制御連合講演会 343/344 (2012)
[4] 古谷栄光,黒澤拓人,廣田喜一,白神豪太郎,武田敏宏,福田和彦, 麻酔鎮痛度制御のための鎮痛度指標の検討, 第55回自動制御連合講演会,356/357 (2012)
[5] 武田敏宏,古谷栄光,中山裕,白神豪太郎, 鎮痛度指標aepEXより算出したプロポフォール最小効果部位濃度の経時的変化, 第19回日本静脈麻酔学会 (2012)
[6] 酒井智衣, 中山裕, 古谷栄光, 武田敏宏, 白神豪太郎, 麻酔薬に対する応答の時変性を考慮した鎮静度維持のための最小麻酔薬濃度に 基づく鎮静度制御システムの改良, 第57回システム制御情報学会研究発表講演会, 343-5 (2013)
[7] 大田敏嗣, 黒澤拓人, 古谷栄光, 廣田喜一, 武田敏宏, 白神豪太郎, 福田和彦, 複数の鎮痛度指標に基づく麻酔鎮痛度制御法の検討, 第57回システム制御情報学会研究発表講演会,343-4 (2013)
[8] Eiko Furutani, Yuki Nishigaki, Chiaki Kanda, Takehiro Takeda, and Gotaro Shirakami, Hypnosis control based on the minimum concentration of anesthetic drug for maintaining appropriate hypnosis, 35th Annual International Conference of IEEE Engineering in Medicine and Biology, 3483/3486 (2013)
[9] Eiko Furutani, Yutaka Nakayama, Takehiro Takeda, and Gotaro Shirakami, Anesthesia control based on minimum drug concentrations for keeping appropriate hypnosis and analgesia, 計測自動制御学会ライフサイエンス部門シンポジウム (2013)
[10] 谷口将大朗,大田敏嗣,古谷栄光,廣田喜一,武田敏宏,白神豪太郎, 福田和彦, 鎮痛度指標Analgesia/Nociception Indexを用いた鎮痛度制御の検討, 第58回システム制御情報学会研究発表講演会, 342-6 (2014)
[11] Y. Sawaguchi, E. Furutani, G. Shirakami, M. Araki, and K. Fukuda, A model predictive hypnosis control system under total intravenous anesthesia, IEEE Trans. Biomed. Eng., 55-3, 874/887 (2008)
[12] J. Barr, T. D. Egan, et al., Propofol dosing regimens for ICU sedation based upon an integrated pharmacokinetic-pharmacodynamic model, Anesthesiology, 95, 324/333 (2001)
[13] B. Marsh, M. White, et al., Pharmacokinetic model driven infusion of propofol in children, Br. J. Anaesth., 67, 41/48 (1991)
[14] T. W. Schnider, C. F. Minto, et al., The influence of age on propofol pharmacodynamics, Anesthesiology, 90-6, 1502/1516 (1999)
[15] M. Jeanne, R. Logier, J. DeJonckheere, and B. Tavernier, Heart rate variability during total intravenous anesthesia: Effects of nociception and analgesia, Autonomic Neuroscience: Basic and Clinical, 147-1-2, 91/96 (2009)
[16] M. Jeanne, R. Logier, J. De jonckheere, and B. Tavernier, Validation of a graphic measurement of heart rate variability to assess analgesia/nociception balance during general anesthesia, 31th Annual International Conference of the IEEE EMBS, 1840/1843 (2009)
[17] M. Huiku, K. Uutela, et al., Assessment of surgical stress during general anaesthesia, Br. J. Anaesth., 98-4, 447/455 (2007)
[18] H. Viertio-Oja, V. Maja, et al., Description of the Entropy algorithm as applied in the Datex-Ohmeda S/5 Entropy Module; Acta Anaesthesiologica Scandinavica, 48-2, 154/161 (2004)